
深圳市南山区西丽大学城学苑大道1068号, 中国科学院深圳先进技术研究院, 集成所神经工程研究中心
0755-86392299
0755-86392235
0755-86387965
(原文链接https://mp.weixin.qq.com/s/50RkE55TUNXeAYr1n4pXRQ)
侵入性和非侵入性脑刺激方法在神经科学中被广泛使用,以建立不同大脑区域与它们所依赖的感觉、认知和运动功能之间的因果关系。当与脑成像技术相结合时,这种刺激方法可以揭示神经元活动的模式,以及这些模式如何在局部回路水平和广泛网络中调节简单和复杂的行为。了解生理状态和任务需求的波动如何影响大脑刺激对神经活动和行为的影响,是我们如何使用这些工具来理解认知的核心。本文回顾了在对神经刺激响应时大脑活动这种“状态依赖性”变化的概念,并考虑了意识状态改变(例如,睡眠和麻醉)的研究以及基于任务的选择性注意力和工作记忆操作的例子。我们将人类使用的非侵入性方法的相关发现与动物模型中神经元集合的直接电刺激和光遗传学刺激获得的相关发现联系起来。鉴于脑刺激作为实验室研究工具和增强或恢复大脑功能的手段的广泛使用,考虑生理和认知状态变化的影响对于提高这些干预措施的可靠性至关重要。本文发表在Nature Reviews Neuroscience杂志。
1.引言
认知神经科学的一项核心工作是了解大脑区域和网络如何协调其活动以产生感知、认知和行为。在过去的30年中,一个突出的方法是对大脑进行成像,并将活动模式与特定任务条件下的行为相关联。一种不同的方法是使用非侵入性磁刺激或电刺激直接扰动受限制的大脑区域,目的是在局部大脑区域和它们调节的认知过程之间建立因果关系。虽然后一种方法已被证明是成功的,但很明显,由任务需求变化或内源性网络波动引起的持续神经活动的变化可以深刻地影响脑刺激对神经活动和行为的影响(图1)。因此,如果我们要应用神经刺激,无论是对于基本发现还是临床转化,理解和解释这些影响都是至关重要的。近年来的概念和技术进步改变了我们对认知神经机制的理解,并实现了脑刺激和神经影像学方法的同步进行。这反过来又有助于研究脑刺激对大脑活动行为和模式影响的“状态依赖性”。
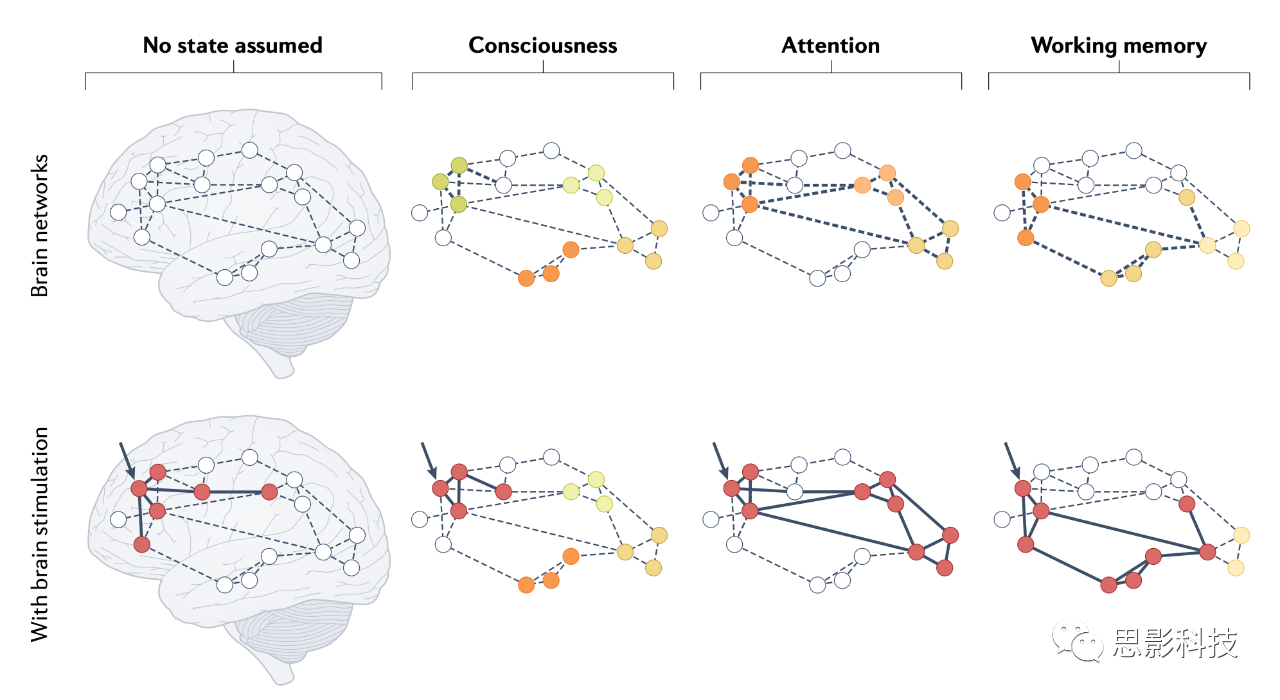
在“静息”大脑中刺激其中一个节点(黑色箭头)可能会破坏、激活或调节节点子集(红色圆圈,全黑线)的兴奋性。此子集可能位于受刺激区域内,也可能涉及更远的节点。然而,大脑很少完全“休息”。相反,它受到警觉性或认知参与度的波动的影响,如我们在本文中考虑的三种示例状态:意识状态、注意力和工作记忆。这些不同的认知状态由网络节点中不同程度的活动以及节点之间连接的调制(彩色圆圈之间的粗虚线)调节。反过来,刺激单个节点(黑色箭头)会导致不同大脑网络(红色圆圈,全线)的募集或破坏,这取决于刺激时的潜在状态。请注意,这种理论描述尤其适用于引起神经元放电的刺激技术(例如,经颅磁刺激和微刺激)。对于调节神经元膜电位的技术(如经颅电刺激),活动变化仍可能通过促进或抑制内源性神经元活动传递到节点的连接上。至关重要的是,参与沟通的特定连接将取决于当前的认知状态及其相关的生理状态。
本文中我们重点介绍了该领域最近的工作,并批判性地评估了对侵入性和非侵入性脑刺激的反应中大脑活动和行为的状态依赖性变化的概念,重点是与认知相关的内源性和任务诱导的大脑活动。在许多领域,包括意识状态、注意力和工作记忆,我们描述了局部和全局大脑活动的变化如何影响同时进行的大脑刺激的响应。我们专注于经颅磁刺激(transcranial magnetic stimulation, TMS)和经颅电刺激(transcranial electrical stimulation, tES),并将人类数据与动物模型的相关发现联系起来(框1)。虽然我们也触及了状态依赖在临床领域的潜在重要性,但对患者研究的详细考虑超出了本综述的范围。
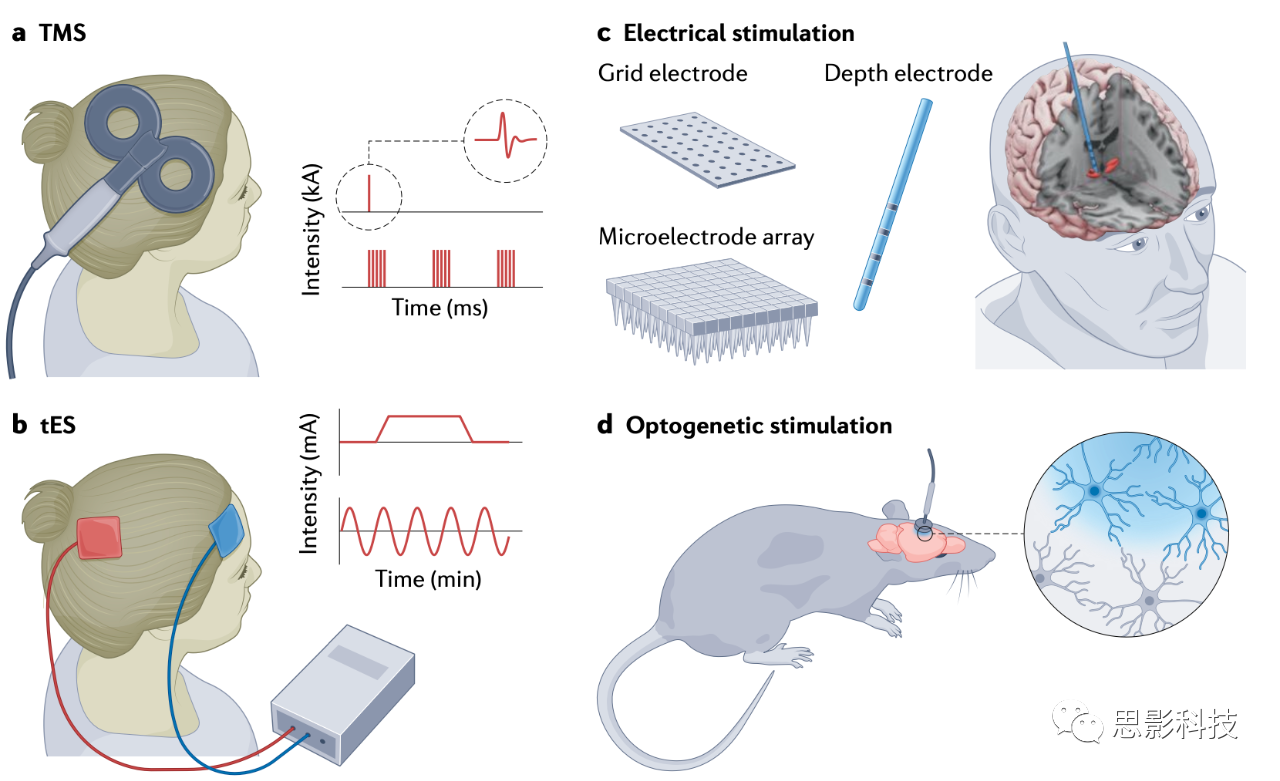
1 人类和动物研究中常用的脑刺激技术
几种不同的脑刺激技术常用于人类和动物研究,它们在侵入性、空间范围和特异性方面有所不同。经颅磁刺激(Transcranial magnetic stimulation, TMS;见下图a部分)使用线圈(蓝色)产生时变磁场,可以使神经元放电。虽然单脉冲TMS可用于探测网络的兴奋性或破坏其正常功能,但重复的TMS涉及不同的脉冲模式和频率,随着时间的推移调节皮质兴奋性,并被认为涉及突触可塑性机制。经颅电刺激(Transcranial electrical stimulation, tES;见图b部分)在至少两个电极之间向头皮传递弱电流。某些电极配置提供更集中的电流分布(高清 tES)。tES的作用机制存在争议,但通常认为调节神经元静息膜电位可能导致对大脑和行为的长期后效应。电流也可以直接施加到脑组织(见图c部分)。这些侵入性方法包括动物模型和人类患者的微刺激。在动物模型中,光遗传学刺激(见图d部分)涉及遗传操作后表达光敏蛋白(视蛋白)的神经元群体的选择性激发或抑制。视蛋白通过植入式光纤传递的激光激活。该技术提供了对靶向神经元群体和刺激模式的精细控制。
总的来说,这里描述的工具正在经历快速发展,并已经启用了新功能。例如,使用两个TMS线圈将精确定时的脉冲传递到两个不同的皮质区域(皮质-皮质成对的结合刺激),可以在任意两个连接区域之间操纵神经可塑性。利用经颅超声刺激和不同频率电场(时间干扰)的全新技术正在出现,实现对更深层大脑结构的非侵入性靶向刺激。
2.是什么造就了“状态(state)”?
我们每天的心理景观充满了无数的状态,包括睡眠和做梦、关注外部物体和事件,以及参与复杂的思想和行动。精神状态和认知状态的这种多样性反映了一系列相关的神经状态。构成神经“状态”的内容将因上下文而异。在这里,我们遵循Zagha和McCormick对状态的定义,即“一组反复出现的神经状况,在一段时间内在行为上是稳定的”。这组神经状况通常反映在正在进行的活动的不同模式中,但也可以通过对刺激的神经反应来揭示。熟悉的例子包括睡眠的不同阶段,其特征是大脑活动不同,或在安静、宁静唤醒、积极探索环境、注意感官辨别过程中出现的独特功能网络。虽然不同的神经状态通常对应于可识别的感知、认知或运动状态,但两者之间并不总是简单的一一对应关系。因此,在评估神经刺激对大脑和行为的不同影响时,考虑神经和行为术语中定义的“状态”至关重要。
从广义上讲,神经活动可以在分子和细胞、微环路、局部网络或整个大脑系统的水平上表征。相应地,捕获活动的方法可能侧重于神经元放电模式(例如,细胞内记录和多单位活动),细胞外电场(例如,局部场电位和头皮脑电图(electroencephalography, EEG)或仅与神经元活动间接相关的代谢活动(例如,功能性 MRI(functional MRI, fMRI)和光学成像)。另一个重要的考虑因素是,不同大脑状态之间的波动在截然不同的时间尺度上有所不同。在一个极端情况下,大脑状态可能在发育成熟和正常衰老的过程中发生变化,或者随着痴呆等疾病状态的缓慢进展而改变。在这里,我们只关注那些在更短的时间尺度上变化的状态,从几小时(例如,跨睡眠阶段)到数百毫秒(例如,工作记忆中注意力转移或检索)。
3.影响大脑活动
操纵大脑活动可以通过多种方式实现,包括行为、药理或直接刺激干预。在最后一类中,快速发展的选择范围允许在动物和人类中进行侵入性和非侵入性刺激(框1)。在这里,我们总结了人类使用的两类主要非侵入性脑刺激的关键概念:TMS和tES。
3.1经颅磁刺激作为神经网络的探针
TMS使用电磁感应来激发神经元。对于每个传递的TMS脉冲,通过刺激线圈的瞬时电流会产生磁场,磁场又穿过头皮、颅骨和脑组织,导致可兴奋元素中的二次电流。在高强度下,这些电流触发神经元中的动作电位。对人类这种效应最直接的观察是运动诱发电位(motor evoked potential, MEP),它记录在超阈值TMS脉冲传递到初级运动皮层之后的瞬时肌肉收缩。仔细检查脊髓的下降活动可发现连续的活动峰值,这表明TMS脉冲可以直接去极化皮质脊髓锥体神经元,以及投射到锥体神经元上的兴奋性和抑制性中间神经元。使用不同强度的脉冲对的实验,或改变线圈的方向,从而调节皮质内电流,揭示了由运动皮层TMS激活的微环路的细节。然而,当人们将这些发现推断到其他皮质区域时,需要谨慎。TMS脉冲的具体效果将取决于脉冲特性(例如,线圈方向和脉冲持续时间、强度和形状)和受刺激区域的特征,例如皮质折叠(皮质层的角度和轴突的方向和厚度)、细胞类型的分布以及单元之间的连接模式。特别是,已经提出了刺激强度将TMS对行为的总体影响从低强度的促进性转变为高强度的抑制性。不同的刺激强度也可能优先招募不同的神经元亚型。尽管存在这些细微差别,但总体原则是TMS触发动作电位,并通过网络活动对局部微环路施加影响。
TMS对神经网络的影响可以通过不同的方式加以利用。所谓的虚拟病变方法使用TMS,以单个脉冲或多个脉冲的快速序列传递,以破坏任务执行期间特定点的正常神经活动。这种破坏的性质可能涉及在所有神经元中注入“噪声”或激发与任务无关的神经元等过程。另一种方法包括在TMS递送期间记录生理信号,然后将其用作探针以检查感兴趣的神经回路的反应性。例如,MEP振幅可以揭示各种神经系统疾病中皮质脊髓束的完整性,或不同实验条件下的皮质兴奋性。使用TMS在休息或任务期间扰乱局部大脑区域,并通过EEG或fMRI记录由此产生的活动,可以阐明神经活动在网络中传播的途径。
3.2经颅电刺激作为膜电位的调节剂
tES在头皮上提供弱电流(通常在0.5至2 mA之间),电流可以是连续的(经颅直流电刺激(transcranial direct current stimulation, tDCS))或交变的(经颅交流电刺激(transcranial alternating current stimulation, tACS)),也可以根据噪声分布而变化(经颅随机噪声刺激(transcranial random noise stimulation, tRNS))。由此产生的电场分布根据电极的大小、数量和位置而变化,但它通常相当弥漫,不仅覆盖皮层,还覆盖脑脊液、颅骨、皮肤和神经。与TMS相反,tES被认为调节皮质神经元膜电位而不是触发动作电位。这种效应可能间接影响自发和诱发的神经元放电速率,以及神经元之间放电的同步。将电流施加到麻醉猫皮质表面的早期实验表明,通过运动皮层传递的表面阳极刺激通常会增加神经元的放电速率,而阴极刺激会降低放电速率。类似地,在人类中,在运动皮层上递送的阳极tDCS在早期工作中被证明可以增加MEP幅度,而阴极tDCS降低了MEP幅度。导致过度简化的观点,即阳极tDCS是“兴奋性的”,阴极tDCS是“抑制性的”。此后,进一步的人类和动物研究完善了这一观点,这些研究表明,tDCS效应取决于许多因素,包括刺激强度和持续时间、电极蒙太奇和受刺激区域的生理学。tRNS和tACS的假设机制也涉及神经元膜电位调节,可能导致tRNS的随机共振,并在tACS的刺激频率下夹带振荡。这些直接证据一直相互矛盾,进一步研究tES的机制及其跨物种的推广对于该领域的进步至关重要。
3.3随时间推移的持续影响:可塑性诱导
TMS和tES的一个决定性特征是它们可以用来触发行为和大脑生理学的变化,这些变化持续到刺激期之后。例如,将阳极tDCS 输送到运动皮层的时间短至~10 分钟,导致 MEP 振幅在 ~1 小时内增加,脑部影像学检查显示tES后至少15分钟内脑血流量和神经递质浓度发生变化。虽然单个TMS脉冲仅引起短暂的神经元活动,但使用所谓的重复TMS(repetitive TMS, rTMS)连续传递数百个脉冲可导致持久的变化。在该应用中,脉冲的相对时序是后效应的关键决定因素:运动皮层上的低频rTMS(小于5 Hz)通常会降低MEP幅度,而高频rTMS(5 Hz或更高,通常为10或20 Hz)似乎会增加MEP幅度。脉冲的特殊节律模式(例如theta爆发刺激)或中枢和外周刺激的组合(例如成对的联合刺激(paired associative stimulation, PAS))也可导致持久的抑制或兴奋性变化。至关重要的是,无论是运动还是连续的可塑性范式中,都可以可靠地逆转运动皮层rTMS的后效应。这种明显的可塑性后效应逆转通常被解释为稳态过程,以防止“失控”兴奋性变化。与经典动物实验的相似性,以及对脉冲定时和调节神经可塑性的各种药物的敏感性,强烈表明这些长期变化的发生是由于突触可塑性机制的参与。其他类型的可塑性,如非突触神经元、神经胶质或血管变化,也可能有所贡献,但它们的贡献几乎没有被探索过。TMS和tES诱导持续变化的潜力使它们作为治疗工具具有吸引力,并导致在几天或几周内提供多次刺激的研究。重要的是,我们对脑刺激的持续性“离线”后效应的理解仍然相对脱离了对其瞬时作用机制的了解,需要进一步研究。
3.4 脑刺激的活动依赖性效应
研究动作准备和执行的基础工作表明,神经元群体的持续活动水平决定了它对脑刺激的反应程度。一个突出的例子是在目标肌肉的轻度自愿收缩期间传递TMS脉冲,这导致MEP比在休息时传递相同脉冲时观察到的要大得多。在视觉领域也发现了脑刺激的活动依赖性效应。使用一种称为“TMS适应”的方法,该方法已扩展到感官和认知领域。Silvanto及其同事利用了这样一个事实,即一些神经元在从事长时间活动时会减少活动(即“适应”)。TMS脉冲被传递到枕部区域,目的是在呈现有色适应刺激后立即诱导磷化物。磷化物通常是无色的,但在适应后,磷化物具有适应刺激的颜色,这表明TMS激活了适应的、活性较低的神经元回路。这项工作促使Silvanto和Cattaneo提出了TMS效应的兴奋性依赖性滑动尺度,其中TMS强度的促进性到抑制性效应由受刺激神经元的当前状态决定,例如,通过注意力或适应性来控制。因此,在任何给定时间神经群体中兴奋性水平的混合决定了刺激对行为的净影响。
重要的是,虽然脑刺激研究中的活动依赖或状态依赖是一个被广泛接受的概念,但其背后的机制尚未得到很好的理解。持续活动与神经元兴奋性之间的精确关系可能很复杂,而当前的观点已经产生了相反的预测。例如,已经假设tES可以优先调节活跃性网络。或者,由于神经活动通常伴随着膜阻抗的降低,因此可以假设tES在调节活动神经元中的膜电位方面可能不太有效。显然需要更全面地了解脑刺激的状态依赖性效应,特别是在可以理解的描述水平上。
在接下来的部分中,我们介绍了最近的工作,这些工作研究了脑刺激如何与认知相关的持续大脑状态相互作用,如意识(麻醉、睡眠和嗜睡)、注意力和工作记忆领域。在可能的情况下,我们专注于直接比较不同状态下脑刺激效果的研究,并将脑成像作为结果指标。